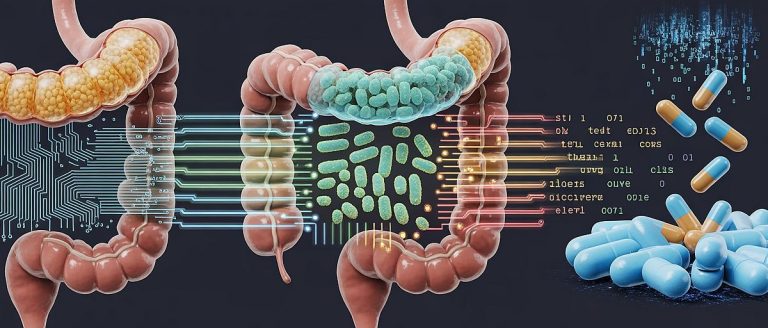
Znanstvenici su otkrili da i najuobičajeniji lijekovi – od antidepresiva do onih za žgaravicu – mogu trajno promijeniti sastav i funkcionalnost naše crijevne flore, s posljedicama koje sežu daleko izvan probavnog sustava.
Crijevni mikrobiom ima reputaciju prilično benignog i neinteresantnog suputnika kojega se spominje u propagandnim pauzama TV programa kad treba opravdati kupnju nekog skupljeg jogurta s bifidobakterijama.
U stvarnosti, međutim, promatramo li ljudsko tijelo kao hardver a naše neurološke funkcije kao programsku podršku, tada mikrobiom možemo opisati kao važan, neizostavni dio našeg firmwarea – golemi, naizgled kaotični ekosustav s milijardama mikroorganizama koji imaju utjecaja ne samo probavu, nego i na imunosni sustav (IT-evsko metaforički: naš ugrađeni antivirusni program), na naše raspoloženje, pa čak i način na koji nam tijelo reagira na vanjske unose, prvenstveno na – lijekove.
Problem nastaje kad shvatimo da upravo lijekovi koje uzimamo kako bismo popravili jednu komponentu sustava, često izazivaju kernel-paniku na sasvim drugom mjestu.
Kako su Estonci „pročitali“ crijeva (Big Data u službi biologije)
Opsežno istraživanje estonskih znanstvenikaobjavljeno u prestižnom časopisu Nature Communicationspokazuje da crijevni mikrobiom posjeduje neizbrisivi log file, reklo bi se – memoriju poput slona. A osobito dobro (ali ne i po dobru) pamti antibiotike, jer oni na naše crijevne suputnike djeluju kao da je među njih bačena mikro-atomska bomba.
Povrh toga, estonska studija otkriva i nešto još puno podmuklije: nisu samo antibiotici pogubni za naš privatni mikrobiom, nego to čine i sasvim obični lijekovi za žgaravicu, depresiju, tjeskobu, tlak ili alergije, koji djeluju kao “tihi saboteri kôda” u mikrobiomskom sustavu.

University of Tartu
Ukratko, gotovo sve što današnji Homo sapiens proguta, mikrobi u crijevima ne samo da registriraju i memoriraju, nego na to reagiraju evolucijskom prilagodbom, koja nam se u nekim slučajevima i ne mora svidjeti.
Ali, prije nego što uđemo u horor-priču o tome što zli lijekovi rade dobrim crijevnim bakterijama, moramo odati počast suvremenoj tehnologiji koja je omogućila ovaj uvid u tajni život (i smrt) našegmikrobioma. Jer prije tek malo više od tridesetak godina mikrobiologija je bila ograničena praktički samo na ono što se moglo uzgojiti na hranjivim podlogama u Petrijevoj posudici. Informatičkim rječnikom, promatrajući samo jednu web stranicu pokušavali smo shvatiti kako radi cijeli Internet.
Estonski mikrobiolozi su, međutim, danas u znatno boljoj poziciji nego prije trideset godina, pa su iskoristili Estonian Biobank, jednu od najnaprednijih genetskih baza podataka na svijetu, uključenu u svojevrsni World Wide Web suvremene mikrobiologije. Povezali su elektroničke zdravstvene kartone s uzorcima DNK i uzorcima stolice tisuća ljudi. Nisu pod mikroskopom tražili pojedinačne bakterije, već su koristili suvremenu genetičku tehniku nazvanu shotgun metagenomics.
Farmakomikrobiomika: kad bakterije „hakiraju“ lijek
“Metagenomika iz sačmarice” je gensko-analitična metoda potpomognuta računalnom tehnologijom, kod koje se uzima sav genetski materijal iz nekog uzorka, razlaže ga se na milijune komadića pa ih se sekvencira (u svakome od njih analizira i očitava genom – redoslijed baza u DNK) i zatim pomoću snažnih algoritama i superračunala uspoređuje očitane genome s podacima iz postojeće baze podataka i na taj način rekonstruira tko je sve prisutan u uzorku: svojevrstanreverse engineering na biološkoj, genskoj razini.
Analizirali su uzorke preko 2.500 odraslih osoba i korelirali ih s podacima o njihovom uzimanju lijekova u posljednjih desetak godina. Rezultat je jedna od najdetaljnijih ikad stvorenih mapa interakcije lijekova i mikrobioma, koja je pokazala da lijekovi ne prolaze kroz nas kao kroz neutralnu sluzavu cijev, nego ulaze u vrlo složeni, živi i živahni kemijski reaktor.
I tako dolazimo do novog buzzworda koji ćete u budućnosti sve češće čuti: farmakomikrobiomika, znanost koja proučava kako bakterije metaboliziraju lijekove.Naime, u svakom centimetru crijevne sluznice odvija se nebrojeno bogatstvo kemijskih poruka. Tamo bakterije, virusi i gljivice komuniciraju pomoću molekula, kako uzajamno, tako i sa svojom biološkom okolinom: našim probavnim sustavom.
U toj bogatoj, orkestralno fino ugođenoj razmjeni kemijskih signala i informacija, lijekovi djeluju kao neočekivani, izvana ubačeni vanjski kod: neki „sviraju“ preglasno, neki potpuno promijene melodiju, a neki se od njih i ne oglase, jer bakterije nekada doslovno „pojedu“ lijek prije nego što on uopće stigne iz crijeva do krvotoka.

Doc/AI
Klasičan primjer je lijek levodopa, standardna terapija za Parkinsonovu bolest. Znanstvenici su godinama razbijali glavu zašto lijek kod nekih pacijenata djeluje savršeno, a kod drugih nikako. Odgovor su našli u crijevima: određene vrste bakterija, poput Enterococcus faecalis, posjeduju enzime koji razgrađuju levodopu u dopamin prije nego što ona prođe krvno-moždanu barijeru. Rezultat? Mozak ne dobiva lijek, ali crijeva dobivaju solidnu porciju predoziranja dopaminom, što uzrokuje vrlo neugodne mučnine. Bakterija je, u suštini, hakirala terapiju.
Sedam veličanstvenih (razarača)
Estonska studija identificirala je čak 186 klasa lijekova kod kojih je opažena interakcija s crijevnim bakterijama, ali njih sedam se izdvojilo kao glavni „administratori“ koji imaju root access našem mikrobiomu i uzrokuju najveće promjene. To su: antibiotici (što je i bilo očekivano), inhibitori protonske pumpe (PPI, lijekovi protiv povišene želučane kiseline), antidepresivi, benzodiazepini, beta-blokatori, glukokortikoidi i lijekovi za dijabetes (poput metformina).
Pogledajmo dakle što to oni točno rade kada se nađu u unutrašnjosti „biokemijskog reaktora“ u našim crijevima.
1. Antibiotici: formatiranje diska bez backupa
Antibiotici su, u metaforičkom smislu, poput asteroida koji imaju potencijal istrebljivanja dinosaura: snažni su i učinkoviti, spasonosni i ponekad neizbježni, ali svako njihovo „ateriranje“ u probavni sustav znači masovno izumiranje mikrosvijeta. Kao da imate virus na računalu, pa se za njegovo uklanjanje služite antivirusnim softverom koji umjesto selektivnog čišćenja od infekcije odluči formatirati cijeli disk: neželjeni virus će nestati, ali nestat će i vaši dokumenti, slike i postavke.
Nakon takvog antibiotsko-asteroidnog udara crijeva se mogu nakon nekog vremena oporaviti, ali nikad u istom sastavu. To se zove „ožiljak na mikrobiomu“. Neki korisni bakterijski sojevi, poput onih koje proizvode butirat (gorivo za stanice crijeva), mogu zauvijek nestati. Na njihovo mjesto dolaze oportunisti – bakterije koje su otpornije, agresivnije i često nose gene za rezistenciju: otporne su na pokušaje da ih se odstrani. Doslovce „dolaze divlji, jer smo otjerali pitome“. Formira se novi ekosustav unutar crijeva koji je možda naizgled ponovo stabilan, ali sada s puno manje funkcionalnosti i sa smanjenom otpornošću na buduće napade.
2. Inhibitori protonske pumpe: gašenje firewalla
Lijekovi za žgaravicu – inhibitori protonske pumpe (PPI), npr. omeprazol, među najprodavanijim su lijekovima na svijetu. Oni smanjuju lučenje želučane kiseline, pri čemu korisnik osjeća olakšanje, no mikrobiom osjeća – invaziju.
Naime, želučana kiselina nije tu samo da probavlja hranu; ona je primarni firewall našeg tijela. Ubija većinu bakterija koje unesemo hranom ili slinom. Kad uzimate lijekove koji smanjuju produkciju kiseline, taj firewall više nema svoju punu funkcionalnost.

Doc/AI
Estonska studija je potvrdila da ljudi na PPI terapiji imaju crijeva puna bakterija koje inače žive u ustima (Streptococcus, Rothia). A te bakterije u crijevima nemaju što tražiti: one tamo izazivaju kaos, mijenjaju metabolizam i povećavaju rizik od ozbiljnih infekcija vrlo neugodnim uzročnicima poput Clostridium difficile. To je kao da ste mrežni port 80 otvori za sav promet – netko će sigurno ući i napraviti štetu.
3. Antidepresivi, sedativi, psihobiotici i „serotoninska veza“
Ovo je dio gdje priča dobiva cyberpunk notu. Antidepresivi (SSRI) i benzodiazepini su dokaz da crijeva i mozak govore istim jezikom, koristeći iste protokole. Znanstvenici sve više govore o osi crijevo–mozak (gut-brain axis), dvosmjernom komunikacijskom autoputu čiji je glavni kolnik vagus („živac-lutalica“), koji povezuje mikrobiom s emocionalnim centrima. Serotonin je poznat kao moždani hormon sreće… ali čak 90% serotonina u našem tijelu se ne proizvodi u mozgu, nego u – crijevima!
Studija je pokazala da psihofarmaci drastično mijenjaju sastav crijevne flore i to sada postavlja pitanje poput onoga o kokoši i jajetu: djeluju li antidepresivi barem dijelom tako što mijenjaju mikrobiom koji onda šalje „sretnije“ signale mozgu? Ili je uništavanje određenih bakterija nuspojava lijeka koja dugoročno može pogoršati stanje?
Eksperimenti na miševima su dali pomalo zastrašujući uvid u te odnose između crijevnog mikrobioma i raspoloženja: ako uzmete crijevni mikrobiom depresivne osobe i presadite ga mišu (tzv. fekalna transplantacija), miš počinje pokazivati simptome depresije i anksioznosti. To sugerira da depresija može biti „zarazna“ putem mikrobioma, a lijekovi tu dinamiku kompliciraju na načine koje tek počinjemo shvaćati.
4. Ostali igrači: beta-blokatori i steroidi
Beta-blokatori (za srce) i glukokortikoidi (steroidi za upale) imaju više „pregovaračko-politički“ pristup: mijenjaju imunosni ton, a time i uvjete za život u inače neprijateljskom okruženju. Steroidi su imunosupresivi – oni stišavaju imunosnu policiju u tijelu. Kad se nadzor smanji, populacije bakterija koje su bile pod kontrolom mogu „podivljati“, dovodeći do stanja poznatog kao disbioza. Disbioza je, u rječniku sistemskog administratora, bloatware – sustav je zagušen beskorisnim ili štetnim procesima koji bespotrebno troše vitalno važne resurse.

Doc/AI
Povijest nesporazuma: tehnički dug čovječanstva
Želimo li bolje razumjeli značaj ovog problema, trebamo pogledati u povijest. Kad je Alexander Fleming 1928. otkrio penicilin, otvorio je eru antibiotika i zatvorio poglavlje ljudske povijesti ispisano milijunskim žrtvama koje su do tada umirale od onoga što danas smatramo banalnim infekcijama. Uvođenje antibiotika – uz cijepljenje – bilo je najveći enhancementpatch u dotadašnjoj povijesti razvoja ljudskog zdravstvenog softvera.
No, gledamo li sada na to s povijesne distance, antibiotici su istovremeno postali i najveći biološki poremećaj koji je Homo sapiens prouzročio u vlastitom organizmu. U manje od stoljeća primjene, antibiotici su skoro u potpunosti promijenili sastav mikrobioma koji se razvijao milijunima godina – u nama i zajedno s nama. To je klasičan primjer onoga što u IT-u zovemo „tehnički dug“: riješili smo akutni problem (infekcije), ali smo stvorili dugoročni problem (gubitak bioraznolikosti i rezistenciju) koji sada dolazi na naplatu – s kamatama.
Usporedbe s plemenima u Amazoni ili Africi koja nemaju doticaj s modernom medicinom pokazuju poraznu sliku: urbani zapadni čovjek ima drastično „siromašniji“ mikrobiom. Izgubili smo cijele klase bakterija koje su zadužene za finu regulaciju imuniteta i metabolizma. Zauzvrat smo dobili alergije, autoimune bolesti i pretilost. Izgubili smo biološku kompleksnost u zamjenu za medicinsku sigurnost, a lijekovi koje svakodnevno gutamo samo produbljuju taj jaz.

Doc/AI
Nevidljive posljedice
Disbioza se na kratke staze rijetko kada manifestira drastičnim simptomima; nema tu nekog iznenadnog „plavog ekrana smrti“. Umjesto zamrzavanja procesora i pojave BSOD-a, disbioza se više zamjećuje kao postupno usporavanje rada cijelog sustava: osjećamo manjak energije, brain fog, kronični umor bez jasnog razloga, promjene apetita…
Na kraće staze to i ne djeluje tako tragično, no dugoročno priča postaje znatno ozbiljnija. Mikrobiom koji je oštećen lijekovima gubi sposobnost obrade prehrambenih vlakana i proizvodnje kratkolančanih masnih kiselina (SCFA). Bez tih kiselina, crijevna stijenka postaje propusna (leaky gut syndrome, sindrom povećane crijevne propusnosti), dopuštajući toksinima da uđu u krvotok i izazovu kroničnu, pritajenu, tinjajuću upalu.
Danas znamo da je ta upala tihi ubojica u pozadini dijabetesa tipa 2, metaboličkog sindroma, pa i neurodegenerativnih bolesti poput Alzheimera. Ironija je potpuna: lijekovi koje pijemo za kronične bolesti, mogu putem oštećenja mikrobioma poticati upravo one mehanizme koji te bolesti uzrokuju i pogoršavaju ih.
Znači li sve ovo da trebamo prestati piti lijekove? Apsolutno ne. Odbaciti modernu medicinu iz straha od disbioze bilo bi jednako besmisleno kao odbaciti pametni telefon iz straha da će nas Google pratiti (iako nas – realno gledajući – zaista prati… ali ostavimo tu temu za neke druge prilike!).
Personalizacija budućnosti
Lijekovi spašavaju živote.Ali, način na koji ih propisujemo mora se promijeniti. Trenutni model primjene lijekova je uniforman za sve korisnike – „one size fits all“, što je racionalna i oportunistička uravnilovka. Ali, kako znamo, nismo svi isti – što itekako vrijedi i za način metaboliziranja i biološke distribucije lijekova u organizmu, u čemu jednu od presudnih uloga igra sastav i kvaliteta našeg crijevnog mikrobioma, koji je individualan i različit kod svakog od nas.Stoga svatko od nas posjeduje individualne varijacije koje bi trebalo uvažavati i ne gubiti ih iz vida.
Budućnost farmakologije leži u personalizaciji vođenoj umjetnom inteligencijom.Vrlo vjerojatan scenarij za nekih desetak godina – u onim zdravstvenim sustavima koji budu svojim korisnicima omogućili pristup state-of-the-art razini medicinskih usluga (dakle, možda baš i ne u ovom „regionu“) – dolazite liječniku zbog žgaravice ili depresije ili visokog tlaka, pa nakon utvrđene dijagnoze, a prije nego što vam ispiše recept, dajete uzorak stolice. Sekvencer u ordinaciji (ili u laboratoriju povezanom online) za par sati proanalizira vaš mikrobiom.AI algoritam potom vrti simulaciju: „Ako pacijentu damo Lijek A, njegova kolonija Bacteroidesa će ga razgraditi prije djelovanja. Ako damo Lijek B, izazvat ćemo disbiozu i proljev. Optimalan izbor je Lijek C, ali uz dodatak probiotika soja X i Y kako bi se zaštitila sluznica.“
Znanstvenici već rade na tome. Mapiranje „mikrobiomskog potpisa“ svakog lijeka postaje prioritet farmaceutske industrije. Također, razvijaju se inhibitori bakterijskih enzima – male molekule koje bi se davale uz lijek, s jedinom svrhom da spriječe bakterije da „pojedu“ ili unište glavni lijek. Kao da uz antivirusni program instalirate i add-on koji specifično štiti vaše bankovne transakcije.

Doc/AI
Ima li šanse za System Restore?
Dok čekamo tu futurističku medicinu, što možemo učiniti već danas? Može li se crijevna flora oporaviti nakon desetodnevne kure antibiotika ili nakon brojnih godina provedenih na tabletama za žgaravicu?Djelomično može, ali rijetko je taj oporavak potpun. U našem organizmu nema Reset tipke, pa u ljudskoj fiziologiji ne postoji System Restore Point na način na koji postoji u Windowsima.
Ključnu ulogu u oporavku mikrobioma igra „input“, odnosno prehrana. Hrana bogata prebiotičkim vlaknima (poriluk, češnjak, artičoke, cjelovite žitarice) djeluje kao hranjivo gnojivo za dobre bakterije. Fermentirane namirnice (kefir, kiseli kupus, kimchi) unose nove, žive sojeve, iako je upitno koliko se oni trajno „naseljavaju“, a koliko samo prolaze kroz sustav.
S druge strane, rafinirani šećeri i visokoprocesirana hrana su kao da hakerima dajete administratorske lozinke – oni hrane upravo one divlje bakterije koje želimo eliminirati jer su u našim crijevima zauzele životni prostor „dobrom mikrobiomu“ kojega smo prethodno izbombardirali antibioticima i drugim nekritički doziranim terapijama.
Suživot s kolektivnim entitetom
Svaka osoba u sebi nosi oko kilogram i pol mikroorganizama. U brojkama, to znači da u nama živi otprilike isti broj „stranih“ koliko i vlastitih stanica. Ali, ako gledamo po ukupnom broju gena, golema većina genskog koda u nama pripada mikrobima:procjene govore da na naših dvadesetak tisuća gena dolazi stotinjak pa i više puta više mikrobnih. Taj kolektivni entitet u nama nije samo „slijepi putnik“, on je naš suputnik; štoviše – on je naš kopilot: sposoban je sintetizirati vitamine koje mi ne možemo, razgrađivati toksine koji bi nas inače ubili i stvarati molekule koje mijenjaju naše misli i ponašanje.
Kad se to uzme u obzir, nije pretjerano reći da svatko od nas u sebi nosi čitav ekosustav, živi planet s klimatskim promjenama, invazivnim vrstama i lokalnim ratovima. Lijekovi su u toj priči moćno oružje kojim čovjek nesvjesno kolonizira i mijenja samoga sebe: spasili su milijune života, ali su pritom preoblikovali ono najintimnije što imamo: vlastiti biokemijski identitet.
Mikrobiom se ne može svesti na lifestyle trend ni na skupe probiotike iz TV-reklama. On je temeljna fiziološka komponenta koja spaja biologiju, neurologiju i farmakologiju u zajedničku priču o tome tko smo i kako funkcioniramo. Ignoriranje utjecaja lijekova na mikrobiom više nije opcija. Lijekovi jesu i dalje nužni, ali svijest o njihovu mikrobiološkom otisku mora postati dio opće zdravstvene pismenosti.
A dok farmaceuti ne počnu na kutijicama tiskati upozorenja poput „Oprez! Može izazvati egzistencijalnu krizu među vašim crijevnim bakterijama“, jedino što preostaje jest – paziti koga u nama hranimo. Jer nitko od nas nije samo jedna osoba, nego hodajući, pričajući i (ponekad) lijekovima tretirani superorganizam. I vrijeme je da se počnemo tako i ponašati.

Igor „Doc“ Bereckije pedijatar-intenzivist na Odjelu intenzivnog liječenja djece Klinike za pedijatriju KBC Osijek. Pobornik teorijske i praktične primjene medicine i znanosti temeljene na dokazima, opušta se upitno ne-stresnim aktivnostima: od pisanja znanstveno-popularnih tekstovau tiskanom i online-izdanju časopisâ BUG, crtkanja računalnih i old-schoolgrafika i dizajna, zbrinjavanja pasa i mačaka, fejsbučkog blogiranja o životnim neistinama i medicinskim istinama, sve do kuhanja upitno probavljivih craft-piva i sasvim probavljivih jela, te neprobavljivog sviranja bluesa.
Datum i vrijeme objave: 29.11.2025 – 07:31 sati